e-ISSN: 2319 - 9849
e-ISSN: 2319 - 9849
Divyamshu Surabhi1*博士Nagamanju年代2
1生物技术学系Chaitanya巴拉蒂理工学院(CBIT),海德拉巴,Telangana、印度
2部门遗传学科学和生物技术,餐馆的维韦卡南达学院,人文和商业、海得拉巴,印度Telangana
收到日期:31/08/2021;接受日期:13/10/2021;发表日期:20/10/2021
访问更多的相关文章dota2雷竞技
能源是驱动各种流程的基本单位之一。其中,热或热能在本质上是相当丰富;通常外发布系统作为副产品。总总结内部能量存储在反应物或生成物的焓(H)。丢失或通过一个系统的热量等于燃烧焓的变化或ΔH。本研究尝试探讨哦官能团的位置是否在甲醇、丙胺和2-methylpropan-2-ol有任何影响标准焓的变化。量热计是用来计算的标准焓变燃烧的酒精,通过提高温度100 g的蒸馏水从其初始温度30摄氏度。水被加热使用酒精灯用20毫升的特定的酒精;它燃烧记录之前和之后的质量。与所有三醇过程重复三次。获得的最终值分别为-41.8±0.10 KJ摩尔1-114±0.39 KJ摩尔1-114±0.38 kj摩尔1为甲醇,分别propan-2-ol和2-mehtylpropan-2-ol。目前的研究表明,标准燃烧焓的变化从初级到中级增加酒精。这是由于相同数量的碳碳键或碳链长度相同。只有轻微的变化±0.01 KJ摩尔1被观察到。这种变化存在作为标准燃烧焓的变化不仅是依赖c键的性质也邻近组织,因为他们有不同的生成焓。结论醇的标准燃烧焓变影响碳碳键的数量,其R组和几何异构现象。
焓、热化学、热容。
能源是一种最基本和最迷人的单位构成的现实。没有能源就不会存在!是背后的驱动力的行动和反应。谈论的驱动力;人会遇到两个方面;功和热量。工作的定义是能量转移到对象的运动。热是能量转移到原子和分子的运动(1]。一切存在倾向于做一些工作在某种程度上,主要遇到的一个常见形式的能量称为热或热能。尤其是在地球上完成工作。因为,热量非常普遍和部分无处不在;因此本研究拟探索热力学领域或者特定的热化学。
热化学指的是研究热能吸收或释放的化学反应。这些反应可以是放热:释放的热能或吸热:吸收热能(2]。系统内的能量吸引表示为焓。焓(H)被定义为总内部能量之和存储在反应物或产物。然而,由于众多un-controlled绝对不能确定焓变量,但可以计算焓变。燃烧焓变或ΔH等于失去的热量或获得的系统。它假设计算压力作用于系统是恒定的。因此,方程ΔH = mcΔt或者q(符号得到或者失去的能量系统)出现(3]。
燃烧的定义是一个放热反应,发生燃料和氧化剂之间最终在光和热的形式释放能量。本研究关注的是标准的燃烧焓的变化 。这是一摩尔物质经历完全燃烧时存在的氧气在标准条件下(298 K和100 KPa压力)4]。
。这是一摩尔物质经历完全燃烧时存在的氧气在标准条件下(298 K和100 KPa压力)4]。
基于相关性的研究碳链的长度和5个主要的燃烧焓醇(5]。从今以后,研究旨在找到“如何的位置哦官能团醇效果标准燃烧焓的变化?“哦,官能团的位置影响酒精的物理和化学性质;这些属性的变化可能会影响标准的燃烧焓变醇。
醇烃链,含有一个羟基(-哦)官能团和C的一般公式nH2 n + 1哦。醇类分为三类:初级,二级和三级6]。
主要醇
醇类,分为这一类的碳原子羟基(-哦)连着一个烷基。可能的例子是乙醇和甲醇(图1和图2)。
二级醇
这里的碳原子羟基(-哦)连着两个烷基组。例子是propan - 2-ol和butan-2-ol (图3和图4)。
叔醇
他们的碳原子的羟基(-哦)连着3烷基组。例如,2-methylpropan-2-ol和2-methylbutan-2-ol (图5、6和表1所示)。
| 变量 | |
|---|---|
| 独立的 | 酒精使用的类型(小学,中学,三级) |
| 依赖 | 酒精燃烧的质量/燃烧 |
| 控制 | |
|
|
表1。变量。
| 装置 | 材料 |
|---|---|
| 重平衡(±0.01) | 甲醇(伯醇) |
| 温度计(±0.5) | Propan-2-ol或异丙醇 (二次酒精) |
| 铜量热计 | 2-methylpropan-2-ol (叔醇) |
| 3种不同的精神灯,以防止交叉污染。 | 蒸馏水 |
| 风盾 | 组织 |
| 滴定管站 | - - - |
表1 b。设备和材料。
检查的影响哦官能团的定位。以下醇实验。
•甲醇(初级)
•异丙醇或丙胺(二次)
•2-methylpropan-2-ol(三级)
•监督建议当试验高度易燃液体和蒸气。
•使用手套,以避免皮肤接触可能导致中等程度皮肤过敏和误食可能导致雷竞技网页版胃肠刺激。
•总是戴护目镜和任何接触眼睛可能引起严重的眼睛刺激。雷竞技网页版
实验者建议戴上面具,同时进行实验因为吸入过量可能导致恶心、头痛导致无意识。
实验设置
为主,标准的铜量热计被裹一层薄薄的海绵绝缘,在一层铝箔;防止海绵融化。
以类似的方式,一个盖子防止热损失。通过温度计放置和夹滴定管架;防止温度计尖端接触铜底——这可能会改变温度读数的准确性。
后,绝缘量热计是放在三脚架站在酒精灯。酒精灯略高的帮助下一个小盒子。使用相同的小盒子在整个实验过程中保持酒精灯之间的距离和量热计常数。三个风盾(木板)被放置在系统保护圣火从狂风所示图7。
1。测量100毫升或100 g的蒸馏水和注入量热计。
2。水的初始温度记录
3所示。测量20毫升的酒精和它的质量。并把酒精倒进酒精灯。
4所示。驻扎风盾系统,以防止热损失和保护周围狂风的火焰。
5。酒精灯点燃,立即放置在量热计。
6。试验一直持续到水的温度增加了其初始温度30℃形式。
7所示。火焰被扑灭后立即和30℃温度从最初的上升。
8。和酒精的质量即立即测量。,to prevent the alcohol vapours from escaping as alcohols are highly volatile in nature.
9。酒精灯让冷却一会儿。与此同时,剩下的酒精倒进烧杯和放置远离实验区域,以防止任何火灾事故。
10。前面的步骤被重复的所有3醇至少3试验。
注意:强烈建议使用不同的精神为每一个酒精灯,以防止交叉污染。
数据分析
由于酒精灯被超过200 g(上图敏感的容量平衡可用)。61.05 g的烧杯是用来权衡酒精的质量在整个调查(表2 - 4)。
| 数据收集(甲醇) | ||||
|---|---|---|---|---|
| 烧杯的体重= 61.05克(±0.01) 水= 100克或100毫升(±0.01) |
||||
| 甲醇 | 初始质量(g) ±0.01 |
最终质量(g) ±0.01 |
初始温度(°C) ±0.5°C |
最后临时(°C) ±0.5°C |
| 试验1 | ||||
| 32.08克 | 20.53克 | 25°C | 55°C | |
| 试验2 | ||||
| 30.79克 | 22.17克 | 25°C | 55°C | |
| 试验3 | ||||
| 33.54克 | 24.79克 | 24°C | 54°C | |
表2。原始数据-甲醇。
| 数据收集(Propan-2-ol) | ||||
|---|---|---|---|---|
| 烧杯的体重= 61.05克(±0.01) 水= 100克或100毫升(±0.01) |
||||
| Propan-2-ol | 初始质量(g) ±0.01 |
最终质量(g) ±0.01 |
初始温度(°C) ±0.5°C |
最后临时(°C) ±0.5°C |
| 试验1 | ||||
| 33.63克 | 25.49克 | 23°C | 53°C | |
| 试验2 | ||||
| 32.46克 | 28.16克 | 24°C | 54°C | |
| 试验3 | ||||
| 32.44克 | 24.46克 | 24°C | 54°C | |
表3。原始数据——Propan-2-ol。
| 数据收集(2-methylpropan-2-ol) | ||||
|---|---|---|---|---|
| 烧杯的体重= 61.05克(±0.01) 水= 100克或100毫升(±0.01) |
||||
| 2-methylpropan-2-ol | 初始质量(g) ±0.01 |
最终质量(g) ±0.01 |
初始温度(°C) ±0.5°C |
最后临时(°C) ±0.5°C |
| 试验1 | ||||
| 32.46克 | 25.41克 | 24°C | 54°C | |
| 试验2 | ||||
| 31.46克 | 24.46克 | 24°C | 54°C | |
| 试验3 | ||||
| 31.43克 | 24.39克 | 25°C | 55°C | |
表4。原始数据——2-methylpropan-2-ol。
数据处理
以上计算数据被用来计算标准燃烧焓的变化。假设所有的能量生成或在燃烧时释放的酒精已经成功转移到水里没有任何热量损失。上面的前提是基于1圣热力学定律,即能量守恒定律。州,在一个孤立系统的总能量总是常数,能量既不能被销毁或创造,但只能从一种形式到另一个任务或者从一个系统转移到另一个系统(9]。
把上面的守恒定律和盖斯定律;标准计算燃烧焓变。盖斯定律指出,化学反应的焓变化路径独立的意义,即使化学反应发生在一个步骤或一系列步骤反应的焓变不变。考虑到反应开始于相同的反应物和以相同的产品没有任何外部干扰(10]。
在热化学反应的能量=改变水的热能
∴ΔHϕ= mcΔt(水)的质量、比热容、温度(3]
上述方程满足的一摩尔物质发生燃烧。
模型计算的燃烧焓变的甲醇
甲醇的质量变化(试验1):32.08 - 20.53 = 11.55 g
甲醇的质量变化(实验2):30.79 - 22.17 = 8.62 g
甲醇的质量变化(实验3):33.54 - 24.46 = 9.08 g
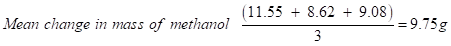
→意味着质量计算降低随机误差的影响。
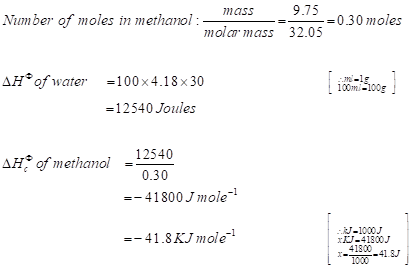
→负号代表热能的损失或热能的释放。
相同的模型计算将被应用到所有的醇计算燃烧焓变(表5)。
| 审判(s) | 质量的变化(g) ±0.02 |
的意思是质量(g)±0.02 | 不。摩尔数 | ΔHφ水(J) | ΔHφc酒精(s) (J摩尔1) |
ΔHφc酒精(s) (kJ摩尔1) |
|---|---|---|---|---|---|---|
| 甲醇 | ||||||
| 1 | 11.55 | 9.75 | 0.30 | 12540年 | - 41800 | - 41.8 |
| 2 | 8.62 | |||||
| 3 | 9.08 | |||||
| Propan-2-ol | ||||||
| 1 | 8.14 | 6.81 | 0.11 | 12540年 | - 114000 | - 114 |
| 2 | 4.3 | |||||
| 3 | 7.98 | |||||
| 2-methylpropan-2-ol | ||||||
| 1 | 7.05 | 7.03 | 0.11 | 12540年 | - 114000 | - 114 |
| 2 | 7.00 | |||||
| 3 | 7.04 | |||||
表5所示。计算燃烧焓变。
更好地代表结果,绝对的不确定性必须计算为每个酒精。绝对不确定度计算,总百分比计算最初的不确定性。这样做的所有不确定性值在这个实验中使用的仪器需要总结按以下方法和方程(5]。
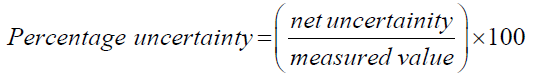
总比例的不确定性大规模的水+ % = %的不确定性不确定性的温度+ %醇的质量变化的不确定性。

→变量(z)占醇的质量的变化;由于它不是常数。(表6)
| 醇 | 意思是醇的质量(g) ±0.02 |
%酒精燃烧的不确定性 | 总%酒精燃烧的不确定性 |
|---|---|---|---|
| 甲醇 | 9.75 | ±0.21 | ±0.25 |
| Propan-2-ol | 6.81 | ±0.29 | ±0.34 |
| 2-methylpropan-2-ol | 7.03 | ±0.28 | ±0.33 |
表6所示。计算总比例的不确定性。
现在,使用上面的总百分比计算的不确定性;绝对的不确定性可以计算。绝对的不确定性是所需的值的绝对误差区域可以存在。它可以通过乘以总百分比计算与测量值的不确定性。
Propan-2-ol模型计算,
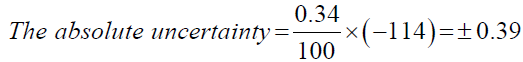
从上面的图1,它可以解释燃烧焓变醇增加了随着碳链的长度增加。标准的燃烧焓的值获得醇不同于科学界的实际值记录。他们获得使用1摩尔的酒精标准条件接受完全燃烧,因此不是相比(表7)。
| 绝对不确定度 | |
|---|---|
| 甲醇 | ±0.10 |
| Propan-2-ol | ±0.39 |
| 2-methylpropan-2-ol | ±0.38 |
表7所示。计算绝对不确定性。
目前调查发现“噢,官能团的位置如何醇效果标准燃烧焓变化?”。获得的实验结果展示了哦主要官能团的位置,二、三级碳影响燃烧时的标准焓变化主要醇叔醇,作为显示在图1。尽管,实验结果显示,随着哦官能团的位置变化,标准的二次酒精燃烧焓变化(Propan-2-ol)和标准的燃烧焓变化叔醇(2-methylpropan-2-ol)表现出相同数量(-114 KJ摩尔1与未成年人)的差异±0.01 KJ摩尔1。醇的标准燃烧焓的变化直接影响参与反应的碳链的长度(11]。换句话说,醇的燃烧焓深受参与反应的碳碳键的数量——这意味着更多的碳碳键导致长烃链,从而吸引更多的能量在共价键。导致更高的标准燃烧焓(11]。
然而,与相同数量的化合物碳碳键或碳链的长度相同但是不同的几何结构有不同的标准燃烧焓值。例如(12]
•1-butanol:−2671 KJ摩尔1
•2 -丁醇:−2661.1 KJ摩尔1
•异丁醇:−2662.6 KJ摩尔1
•叔丁醇:−2644.8 KJ摩尔1
这种变化往往存在燃烧焓不仅依赖于c键的性质也是R组。周边组织有不同的形成焓因此,可能会导致轻微的燃烧焓的变化。同时也指出,如果邻近的R组c哦债券一样在两个不同的烃链但有不同的定位;他们仍然展示相同的燃烧焓。这一现象被发现,当比较两个烃链,镜子被称为对映体(12]。
总之,目前的调查指出,标准的燃烧焓的变化不仅仅是依赖碳氢化合物链的长度也其几何变化和R组。